Expertos en Leishmaniosis
patrocinado por:



PM-ES-23-0330
Contenidos
Haz clic en los distintos apartados para ir al contenido

Módulo La pregunta más difícil: “¿Se puede morir?” El pronóstico: en lo que nunca puedes fallar (estadificación clínica, tratamiento y pronóstico en CanL) patrocinado por Seresto® y Advantix® de Elanco
Autor: Oscar Cortadellas, LV, PhD, Acred AVEPA Medicina Interna, Profesor Asociado Dep. Medicina y Cirugía Animal en HCV - Universidad CEU-CH. Clínica Veterinaria Germanías.

PodCast
10 audiotips: Las preguntas que debes hacer para construir un buen plan de prevención frente a CanL (recomendaciones preventivas basadas en el nivel de riesgo de infección por L. infantum) patrocinado por Seresto® y Advantix® de Elanco
Autor: Oscar Cortadellas, LV, PhD, Acred AVEPA Medicina Interna, Profesor Asociado Dep. Medicina y Cirugía Animal en HCV - Universidad CEU-CH. Clínica Veterinaria Germanías.

Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia) patrocinado por Seresto® y Advantix® de Elanco
Autor: Oscar Cortadellas, LV, PhD, Acred AVEPA Medicina Interna, Profesor Asociado Dep. Medicina y Cirugía Animal en HCV - Universidad CEU-CH. Clínica Veterinaria Germanías.

PodCast
10 audiotips: Hemograma y proteinograma: entendiendo mejor el diagnóstico y la monitorización laboratorial de la CanL patrocinado por Seresto® y Advantix® de Elanco
Autor: Oscar Cortadellas, LV, PhD, Acred AVEPA Medicina Interna, Profesor Asociado Dep. Medicina y Cirugía Animal en HCV - Universidad CEU-CH. Clínica Veterinaria Germanías.
Seresto® y Advantix®
 Expertos en Leishmaniosis
Expertos en Leishmaniosis
MiElanco - Creces tú, crecemos todos
En MiElanco encontrarás servicios conocimientos y recursos de Elanco para ayudarte en tu práctica diaria con tus clientes. ¡Estás a un click de acceder a todos lo contenidos! Aquí tienes el codigo para tu registro: MiElancoDigitalPetShop2023
VETNIA es la comunidad de los profesionales de la salud animal
Un programa creado para reivindicar la importancia de la profesión veterinaria para la sociedad, apostar por el conocimiento, la formación y la salud de los profesionales, e impulsar el negocio de la clínica veterinaria
Portal Veterinario de Elanco
El espacio creado por y para los profesionales que amamos los animales y cuidamos su salud y bienestar, donde encontrarás materiales, formaciones y soluciones que te ayudarán en tu práctica diaria.
Fichas técnicas de Seresto® y Advantix®
Prevención más allá de los ectoparásitos
Seresto®: mecanismo de acción. Seresto® es un collar antiparasitario para perros y gatos. Combina dos principios activos: imidacloprid (10%) y flumetrina (4,5 %).
Estudios sobre las CVBD
La leishmaniosis es una de las enfermedades caninas de transmisión vectorial (CVBD) más importante y de mayor gravedad, ya que puede ser mortal en perros.
Contenidos para tus redes sociales
Con el objetivo de poner luz sobre este riesgo, en Elanco iniciamos una campaña para concienciar a los propietarios sobre la importancia de proteger a su perro todos los días y noches del año.
Formación WhatsApp
Microlearning vía WhatsApp
Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Patrocinado por Seresto® y Advantix® de Elanco

Oscar Cortadellas
LV, PhD, Acred AVEPA Medicina Interna, Profesor Asociado Dep. Medicina y Cirugía Animal en HCV – Universidad CEU-CH. Clínica Veterinaria Germanías.
Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Parte 1


1.1
Haz clic en la imagen para obtener una vista más ampliada
Fármacos habituales, pero no únicos
En la literatura científica se han descrito más de 20 fármacos con una cierta actividad “in vivo”/“in vitro” frente a Leishmania spp, aunque solo unos pocos han demostrado eficacia clínica en pacientes enfermos. En la actualidad, los más usados en el control de la CanL son el antimoniato de meglumina (AM), el alopurinol, la miltefosina, la combinación de nucleótidos/AHCC y la domperidona. Otros fármacos con efectividad variable pero que por diversas circunstancias no son empleados de modo habitual en el perro incluyen anfotericina B, aminosidina, marbofloxacina, pentamidina o la combinación metronidazol/espiramicina.
1.2
Haz clic en la imagen para obtener una vista más ampliada
Para tratar: protocolos validados (ni experiencia personal, ni recomendaciones)
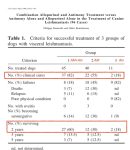
Tradicionalmente, los clínicos trataban la CanL con protocolos basados en su experiencia personal o recomendaciones de otros clínicos “expertos” en la enfermedad, pero sin aplicar criterios científicos a sus decisiones. Afortunadamente, desde hace casi 15 años disponemos de protocolos de tratamiento validados por grupos de expertos internacionales (Leishvet y CLWG) en base a la eficacia clínica demostrada, y son los que deberíamos usar. A pesar de ello, en un estudio publicado en 2020 se evidenció que aproximadamente 1/3 de los clínicos españoles podría estar ignorando estas recomendaciones.
1.3
Haz clic en la imagen para obtener una vista más ampliada
Protocolo actual de primera elección
Actualmente, el protocolo de tratamiento de primera elección en la CanL incluye la administración de AM (100 mg/kg/día/30 días/sbc) y alopurinol (10 mg/kg/12h/6 – 12 meses/po). Por lo que hace al AM, la farmacocinética del fármaco sugiere que la dosis diaria debería administrarse dividida en 2 (50 mg/kg/12 horas). Aunque puede administrase vía endovenosa o intramuscular, la farmacocinética y/o efectos secundarios lo desaconsejan; por ello, salvo contraindicaciones, se administrará siempre vía subcutánea. En cuanto al alopurinol, la duración del tratamiento se ajustará a la situación clínica del paciente y resultados de las pruebas de laboratorio obtenidas durante la monitorización, pero salvo que aparezcan contraindicaciones importantes, nunca debería ser inferior a 6 meses.
1.4
Haz clic en la imagen para obtener una vista más ampliada
Efectos secundarios del AM
Los efectos secundarios asociados a la administración de AM descritos con mayor frecuencia incluyen dolor e inflamación en el punto de inyección. Además, y con menor frecuencia se han reportado vómitos, postración, mialgia, artralgia, fiebre, diarrea, hiporexia, pancreatitis (raramente) y elevación transitoria de las enzimas hepáticas. En personas se han descrito cambios reversibles en la onda T y el intervalo QT del ECG que no suelen verse en el perro. Durante mucho tiempo se consideró que el AM era nefrotóxico, y se contraindicaba su uso en pacientes con afectación renal. Sin embargo, no se ha podido demostrar que este fármaco induzca daño renal clínica o laboratorialmente significativo en pacientes con función renal adecuada. En cualquier caso, su excreción mayoritariamente renal, sugiere que en pacientes con filtración renal reducida debe ser usado con precaución, haciendo una monitorización adecuada y ajustando la dosis si se considera necesario.

Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Parte 2


2.1
Haz clic en la imagen para obtener una vista más ampliada
El alopurinol, monitorizado
El alopurinol ha sido usado durante muchos años de un modo bastante “indiscriminado” en el manejo de la CanL. Los propietarios lo adquirían frecuentemente sin prescripción ni control veterinario, y algunos clínicos lo prescribían incluso “de por vida” y con escasa o nula monitorización, basándose en la falsa creencia de que se trataba de un fármaco seguro y sin efectos adversos. Actualmente sabemos que esto no es así, y que el tratamiento con alopurinol con frecuencia presenta efectos secundarios, siendo los más relevantes los que afectan al tracto urinario. Estos incluyen xantinuria, mineralización renal y urolitiasis, tanto a nivel del tracto urinario inferior como superior. Estos hechos pueden condicionar el tratamiento de la enfermedad, por lo que es fundamental una monitorización adecuada. Con menor frecuencia se describen vómitos, diarrea y reacciones de hipersensibilidad.
2.2
Haz clic en la imagen para obtener una vista más ampliada
¿Y si no se puede con AM o se prefiere oral?
Si existen contraindicaciones para la administración del AM o se prefiere tratamiento oral puede administrarse una combinación de miltefosina (2 mg/kg/24 horas/28 días/PO) y alopurinol (10 mg/kg/12h/6 – 12 meses/PO). Los efectos adversos más frecuentes asociados con la administración de miltefosina son de tipo digestivo (anorexia, vómitos y diarrea), así como elevación transitoria de las enzimas hepáticas. Para reducir su incidencia se recomienda administrar el fármaco con comida. Se ha reportado que la eficacia inicial de este protocolo de tratamiento es similar a la de los antimoniales + alopurinol, pero parece ser que el porcentaje de recaídas es mayor en perros que reciben miltefosina + alopurinol que en los que reciben AM+alopurinol.
2.3
Haz clic en la imagen para obtener una vista más ampliada
Monoterapia, mejor combinando
El alopurinol se viene usando en el tratamiento de la CanL desde hace muchos años y como monoterapia podría tener un cierto papel en el manejo inicial de la enfermedad en perros con daño renal en los que el clínico prefiera inicialmente no usar AG y la miltefosina no fuera una opción. Sin embargo, no hay que olvidar que el alopurinol se considera un leishmaniostático, y que su eficacia como monoterapia es sensiblemente inferior a la de los fármacos leishmanicidas como del antimoniato de meglumina o la miltefosina. Por lo tanto, siempre que sea posible se administrará junto a uno de estos fármacos.
2.4
Haz clic en la imagen para obtener una vista más ampliada
¿Y si con el alopurinol tengo problemas?
Una posible opción terapéutica en pacientes que presentan problemas derivados del uso de alopurinol es la administración de tratamiento combinado a base antimoniato de meglumina (50 mg/kg/12 horas/30 días) y nucleótidos/AHCC (32 mg/kg/17 mg/kg/24 horas/180 días). Un estudio publicado en 2017 concluyó que la eficacia inicial de este protocolo era similar a la del protocolo habitual usando antimoniales/alopurinol, sin los efectos secundarios de este último. Por otra parte, la combinación de nucleótidos/AHCC a las dosis mencionadas y administrada durante 1 año a perros en estadio B (CLWG) parece reducir las posibilidades de que estos animales desarrollen enfermedad clínica, al tiempo que se asocia con una reducción significativa en el título de anticuerpos.

Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Parte 3


3.1
Haz clic en la imagen para obtener una vista más ampliada
Domperidona, como monoterapia, en estadio 1
Con respecto a la domperidona, un estudio publicado en 2009 concluyó que administrada como monoterapia a dosis de 1 mg/kg/12 horas causaba una disminución del título de anticuerpos en prácticamente el 75 % de perros con títulos bajos y signos clínicos ausentes o leves en el momento del diagnóstico, llegando a negativizar el 40 % de ellos. En perros con títulos altos y cuadros clínicos variables, se describió mejoría clínica en el 86 % de los casos y reducción del título de anticuerpos en el 38 % de los perros. Sin embargo, actualmente y como monoterapia, la domperidona se recomienda solo para el estadio 1 (Leishvet) a dosis de 0,5 mg/24 horas. Por otra parte, la domperidona podría tener efectos beneficiosos (todavía no bien investigados) sobre la función renal derivados de su antagonismo sobre los receptores dopaminérgicos D2 a nivel renal. Por último, en perros sanos, la domperidona (0,5 mg/kg/24 horas/30 días, cada 120 días) ha demostrado reducir el riesgo de desarrollo de enfermedad clínica.
3.2
Haz clic en la imagen para obtener una vista más ampliada
Glucocorticoides, según el caso y valorando riesgos potenciales
Aunque es un tema controvertido y existen muy pocas evidencias publicadas al respecto, los glucocorticoides, (generalmente a dosis antiinflamatorias, pero en ocasiones también inmunosupresoras) vienen siendo usados desde hace más de 30 años por algunos clínicos en perros con leishmaniosis que presentan lesiones debidas al depósito de inmunocomplejos, como uveítis, poliartritis o glomerulonefritis. En ausencia de evidencias robustas que soporten su uso rutinario en estos pacientes, la decisión sobre su administración debería tomarse de modo individual, y teniendo en cuenta tanto los posibles efectos beneficiosos como los riesgos potenciales de su uso.
3.3
Haz clic en la imagen para obtener una vista más ampliada
En enfermedad renal, según IRIS
En perros con afectación renal, además de tratar la leishmaniosis debemos tratar siempre la enfermedad renal asociada, de acuerdo con el estadio IRIS que presente el paciente. En cualquier caso, no debemos olvidar que la clasificación IRIS es aplicable a pacientes hemodinámicamente estables. Por ello, antes de clasificar la gravedad de la enfermedad e implementar el tratamiento indicado, debe estabilizarse al paciente y corregirse cualquier anormalidad pre/postrenal que presente.
3.4
Haz clic en la imagen para obtener una vista más ampliada
Abordaje terapéutico: según hidratación, proteinuria, PA, fosfatemia, signos digestivos, acidosis y anemia
Una vez establecido en que estadio está el paciente decidiremos que aspectos del control de la enfermedad priorizar: control del estadio de hidratación (estadios 1 a 4), de la proteinuria (estadios 1 a 4) de la presión arterial (estadios 1 – 4), de la fosfatemia (estadios 2 a 4), de los posibles signos digestivos asociados a la enfermedad renal (estadios 2-4), de la acidosis metabólica (estadios 3-4) y de la anemia secundaria a la ERC (estadios 3-4).

Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Parte 4


4.1
Haz clic en la imagen para obtener una vista más ampliada
Proteinuria y tratamiento: claves importantes
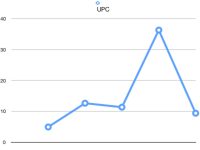
Por lo que hace al control de la proteinuria, de modo general se recomienda tratar si es persistente y UPC > 0,5. Sin embargo, sabemos que en la CanL el tratamiento leishmanicida por si mismo puede reducir significativamente la proteinuria (al menos si inicialmente UPC < 2,1). Por ello, en estos casos el tratamiento antiproteinúrico recomendado por IRIS puede instaurarse en el momento de confirmar la proteinuria o esperar a finalizar el tratamiento leishmanicida, siendo ésta una decisión del clínico. Aunque muchos de estos animales reciben también glucocorticoides, IRIS recomienda inicialmente que el uso de fármacos inmunosupresores se reserve para animales con evidencia histopatológica de que existe un componente inmunomediado activo en la enfermedad, o para pacientes en los que no es posible la realización de biopsias renales pero la enfermedad progresa a pesar del tratamiento estándar. En esta última situación se debe valorar la ratio beneficio/riesgo del tratamiento con la persona responsable de animal y decidir en consecuencia. Actualmente y aunque hay muy pocos datos al respecto, IRIS considera como fármaco de elección el micofenolato mofetilo (10 mg/kg/12 horas), pudiendo asociarse a tratamientos cortos con prednisolona si se considera necesario.
4.2
Haz clic en la imagen para obtener una vista más ampliada
Pedagogía de la enfermedad: información, responsabilidades y calidad de vida
En el momento en que se diagnostica leishmaniosis a un animal, y con independencia del estadio en que clasifiquemos al paciente, los responsables deben ser informados de la necesidad de realizar una monitorización periódica de la evolución de la enfermedad durante el resto de la vida del perro. El cumplimiento adecuado del programa de monitorización permitirá establecer de modo más preciso la evolución de la enfermedad, necesidad de tratar o no, así como y con que hacerlo. Todo ello, tendrá un efecto directo en el pronóstico del paciente. Cuanto mejor hagamos las cosas, más larga y con mejor calidad de vida será la supervivencia del paciente. La periodicidad de esta monitorización y los parámetros a evaluar dependerán del estadio en que se encuentre el animal.
4.3
Haz clic en la imagen para obtener una vista más ampliada
Función renal, clave pronóstica
La valoración de la función renal es crítica en la monitorización de los perros con leishmaniosis y tiene también valor pronóstico. Los perros proteinúricos en estadio IRIS 1-2 en los que la proteinuria remite con tratamiento tienen mejor pronóstico que aquellos en los que esto no ocurre. Igualmente, los perros en estadio 3 – 4 tienen peor pronóstico, pero aquellos en los que la magnitud de la azotemia inicial remite parcialmente con tratamiento, presentan un mejor pronóstico.
4.4
Haz clic en la imagen para obtener una vista más ampliada
Expuestos, ¿qué hacemos?
En pacientes que se encuentran en estadio A (expuestos) se indica inicialmente repetir la serología junto a un examen físico completo 2 – 4 meses después del diagnóstico. Para poder interpretar correctamente los resultados es aconsejable procesar las muestras del mismo animal siempre en el mismo laboratorio y usando la misma técnica analítica. Si esto no es posible, los resultados no son comparables. En función de los resultados pueden indicarse pruebas de detección directa del parásito para determinar si el paciente está infectado o no.

Módulo Protocolizando los tratamientos (fármacos, dosis y efectos adversos a vigilar) y la monitorización de CanL (qué parámetros y con qué frecuencia)
Parte 5


5.1
Haz clic en la imagen para obtener una vista más ampliada
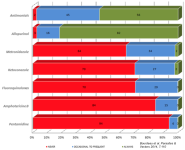
En infectados sin signos clínicos ni clinicopatológicos, ¿qué hacemos?
En los pacientes en estadio B (infectados sin signos clínicos ni clinicopatológicos), además de la monitorización serológica y del examen físico, es conveniente hacer hematología, perfil bioquímico y urianálisis completo cada 2 – 4 meses el primer año tras el diagnóstico y posteriormente cada 6 – 12 meses durante el resto de la vida del animal. El objetivo de estas revisiones es detectar alteraciones que sugieran progresión de la enfermedad (cambios significativos en el título de anticuerpos, y/o en el proteinograma, presencia de anemia y/o trombocitopenia, detección de proteinuria patológica), y por ello necesidad de tratamiento.
5.2
Haz clic en la imagen para obtener una vista más ampliada
En estadio C, ¿qué hacemos?
En general, los pacientes en estadio C son reevaluados al finalizar el tratamiento leishmanicida (1 mes) y posteriormente cada 2 – 4 meses durante el primer año. La monitorización debe incluir hematología, bioquímica, proteinograma, urianálisis y UPC. La monitorización serológica se indica a partir de los 4, o mejor 6 meses postratamiento. Es poco probable detectar cambios significativos en el título de anticuerpos antes, y más, cuando no todos los laboratorios reportan resultados a “punto final”. A partir de ese momento, si la evolución es favorable, los pacientes son monitorizados semestral o anualmente durante toda su vida, con el objeto detectar precozmente potenciales recaídas o reinfecciones que requieran tratamiento.
5.3
Haz clic en la imagen para obtener una vista más ampliada
En estadio D, igual que el C, pero atención con el daño renal
La monitorización de los pacientes en estadio D es similar a la del estadio C, pero debe prestarse especial atención a la monitorización de las alteraciones concomitantes, especialmente a las relacionadas con el daño renal (control de los marcadores de filtración glomerular, proteinuria, fosfatemia, presión arterial). En función de ello, en determinados pacientes pueden indicarse revisiones más tempranas durante el tratamiento leishmanicida, para verificar por ejemplo que no progresa la azotemia días después de iniciar tratamiento con AM o IECAs/ARA2, o que se está logrando un control efectivo de una potencial hipertensión arterial sistémica.
5.4
Haz clic en la imagen para obtener una vista más ampliada
Las PCRs, con algunos condicionantes
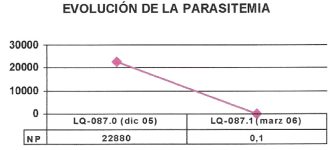
Al igual que para el estadio C, si se hacen PCRs como parte de la monitorización de animales en estadio D, debe tenerse en cuenta que la sensibilidad de la prueba puede variar según el tejido a partir del cual se ha obtenido la muestra. Por ello, a la hora de interpretar los cambios en la carga parasitaria que presenta un paciente es importante obtener siempre las muestras a partir del mismo tejido y considerar cual es su sensibilidad diagnóstica. En cualquier caso, hay que tener en cuenta que estos procedimientos no están totalmente estandarizados y que aún dentro de un mismo tejido, la carga parasitaria puede variar de una muestra a otra. Por ello, los resultados obtenidos deben integrase junto al resto de pruebas realizadas y los resultados del examen físico.
Sigue formándote en "Leishmaniosis" de la mano de Seresto® y Advantix® de Elanco



WhatsVet | Abordaje multimodal de la prevención de la leishmaniosis: chequeos serológicos anuales, repelentes y vacunas
Autoras: Ana Montoya, LV, PhD, Acreditada AVEPA, Diplomada por el Colegio Europeo, Profesor Contratado Doctor del Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid y Marta Mateo, LV, PhD, Profesora Ayudante Doctora. Facultad de Farmacia. Universidad Complutense de Madrid
Podcast | 10 audiotips: Desestacionalización de la leishmaniosis canina: ¿tengo que cambiar mis protocolos?
Autoras: Ana Montoya, LV, PhD, Acreditada AVEPA, Diplomada por el Colegio Europeo, Profesor Contratado Doctor del Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid y Marta Mateo, LV, PhD, Profesora Ayudante Doctora. Facultad de Farmacia. Universidad Complutense de Madrid
WhatsVet | Serología y pruebas complementarias que debes conocer: muestras, procedimientos e interpretación
Autoras: Ana Montoya, LV, PhD, Acreditada AVEPA, Diplomada por el Colegio Europeo, Profesor Contratado Doctor del Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid y Marta Mateo, LV, PhD, Profesora Ayudante Doctora. Facultad de Farmacia. Universidad Complutense de Madrid
Podcast | 10 audiotips: ¿Protocolos de control distintos en distintas áreas geográficas españolas?
Autoras: Ana Montoya, LV, PhD, Acreditada AVEPA, Diplomada por el Colegio Europeo, Profesor Contratado Doctor del Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid y Marta Mateo, LV, PhD, Profesora Ayudante Doctora. Facultad de Farmacia. Universidad Complutense de Madrid